Contenidos Cuarto Periodo
Cinética química y equilibrio químico
-Conceptos básicos
*Generalidades -Def
-teoría de colisiones
*Contenido calórico o entalpía
*Factores que afectan la velocidad de una reacción química
*Paralelo entre reacción exotérmica y endotérmica
*Primera ley de termodinámica
-Equilibrio químico
*Concepto
*Tipos de equilibrio
*Constante de equilibrio
*Principio de LeChatelier
*Equilibrio en soluciones saturadas
*Primera ley de la termodinámica
*Equilibrio en soluciones acuosas
*Equilibrio iónico del agua - KW
- PH
- POH
*Constante de disociación - ácido
- base
*Teorías que explican el comportamiento de los ácidos y bases
EVALUACION
1. Cinética química - 20 %
2. Equilibrio químico - principio de LeChatelier - 20 %
3. Equilibrio en soluciones saturadas - 20 %
4. Blog - 30 %
5. Laboratorio - 10 %
COLISIONES AFECTIVAS
(ORIENTACION ADECUADA)

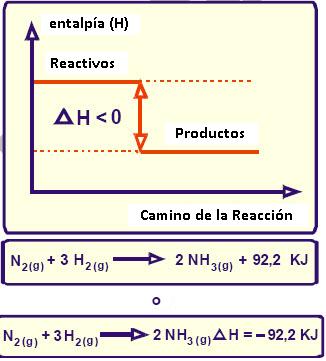
Entalpia : es una magnitud termodinámica, simbolizada con la
letra H mayúscula, cuya variación expresa una medida de la cantidad de energía
absorbida o cedida por un sistema termodinámico, es decir, la cantidad de
energía que un sistema intercambia con su entorno.

los cambios químicos :rupturas de enlaces formación de nuevos enlaces
- colisiones efectivas
- orientación adecuada
- energía

▲
Hf= -▲ >oƟ- RXN endotermica absorbe▲
-▲H<0Ɵ-RXN exotermica libera▲
catalizador: sustancia quimica , no es un reactivo


*la teoria del complejo activado nos dice que la energia
potencial de los reactivos va aumentando de un estado inicial Ea luego baja
rapidamente hasta tener un valor minimo en los productos
E1:E inicial reactivos
EA:energia maxima
ER:energia de productos

COMPETENCIAS
USO COMPRENSIVO DEL CONOCIMIENTO CIENTÍFICO
Planteo y desarrollo problemas de aplicación sobre equilibrio de ecuaciones químicas
Explico la relación entre la velocidad de una reacción y el
equilibrio químico.
Identifico condiciones para controlar la velocidad de
cambios químicos
Identifico las clases de electrolitos y determino el pH y el
pOH de una sustancia
Determino la importancia, el significado y la aplicación de
las soluciones de electrolitos ácidos y bases.
Explica los efectos posibles en el equilibrio de una
reacción cuando se altera la temperatura, la presión y la concentración.
Relaciono los cambios de energía asociados a las reacciones
químicas y aplico variables que influyen en la velocidad de reacción.
Demuestro el
conocimiento y la aplicación de las variables que influyen en la velocidad de
la reacción, como los factores que afectan el desplazamiento del equilibrio en
una reacción química.
Calculo las
concentraciones de los reactivos y/o productos, en un sistema en equilibrio,
conociendo el valor de la constante de equilibrio
INDAGACIÓN
Elabora trabajos prácticos en los que se evidencie la
cinética química y los factores que la afectan
Conozco y aplico las
teorias que explican el comportamiento
experimental de los acidos y las bases, el concepto de pH,ionizacion del
agua,constante de disociación en la solución de problemas acidos-bases.


Equilibrio químico es el estado en el que las actividades
químicas o las concentraciones de los reactivos y los productos no tienen
ningún cambio neto en el tiempo. Normalmente, este sería el estado que se
produce cuando una reacción reversible evoluciona hacia adelante en la misma
proporción que su reacción inversa. Lavelocidad de reacción de las reacciones
directa e inversa por lo general no son cero, pero, si ambas son iguales, no
hay cambios netos en cualquiera de las concentraciones de los reactivos o
productos. Este proceso se denomina equilibrio dinámico.
1.conciente de reaccion
con ese fin va a utilizar el conciente de reaccion Q , que
se calcula utilizando la misma expresion de la constante de equilibrio pero con
una composicion del sistema que puede ser o no equilibrio


se multiplica ambos lados por la concentracion de H2O ambos
lados y se cancela.
al dividir ambos lados entre la concentraciones de agua al
dividir por ambos lados

equilibrio quimico
se representa atravez de una expresión matemática llamada constante de equilibrio
.jpg)
PRINCIPIO DE LECHATELIER
El principio de Le Châtelier, postulado en 1884 por
Henri-Louis Le Châtelier (1850-1936), químico industrial francés, establece
que:
Si se presenta una perturbación externa sobre un sistema en
equilibrio, el sistema se ajustará de tal manera que se cancele parcialmente
dicha perturbación en la medida que el sistema alcanza una nueva posición de
equilibrio
El término “perturbación” significa aquí un cambio de
concentración, presión, volumen o temperatura que altera el estado de
equilibrio de un sistema. El principio de Le Châtelier se utiliza para valorar
los efectos de tales cambios.
actividad:
1-una solución acuosa es cualquier solucion que tiene agua.
Generalmente, las soluciones acuosas son de caráter ácido, debido a que el
agua, si se mezcla ocn algunos otros componenetes puede donar protones
hidrógeno al medio, ahciendo asi que sea
acido.
2-Un electrolito o electrólito es cualquier sustancia que
contiene iones libres, los que se comportan como un medio conductor eléctrico.
Debido a que generalmente consisten en iones en solución, los electrólitos
también son conocidos como soluciones iónicas, pero también son posibles
electrolitos fundidos y electrolitos sólidos.
3-Los electrolitos son
Electrolitos Fuertes : los que se ionizan totalmente en
solución acuosa al pasar corriente eléctrica como las ácidos, como H2SO4, HCl,
HNO3,
Algunas sales iónicas como el NaCl, LiCl, KCl,
Electrolitos débiles: Son los que se ionizan parcialmente en
sol. acuosa y pueden ser los acidos débiles como el CH3COOH acido acético, o
vinagre, el CH3CH2CH2OH,el alcohol, que son muy débiles y son orgánicos, y el
H2O que presentan enlaces covalentes
No electrolitos:De plano son las sustancias que no conducen
lan corriente eléctrica ni sae disocian en sol. acuosa como el azucar, la
madera, el vidrio etc.
4-El pH es una medida de acidez o alcalinidad de una
disolución. El pH indica la concentración de iones hidronio [H3O]+presentes en
determinadas disoluciones.
La sigla significa ‘potencial hidrógeno’, ‘potencial de
hidrógeno’ o ‘potencial de hidrogeniones’ (pondus hydrogenii opotentia
hydrogenii; del latín pondus, n. = peso; potentia, f. = potencia; hydrogenium,
n. = hidrógeno). Este término fue acuñado por el químico danés S. P. L.
Sørensen (1868-1939), quien lo definió en 1909 como el opuesto del logaritmo en
base 10 (o el logaritmo del inverso) de la actividad de los iones hidrógeno
5-


CINÉTICA QUÍMICA
/ \
Velocidad cambios
\ /
Reacción quimica
2. Velocidad de reacción química => cambio en la [ ] de los reactivos en un tiempo determinado
A + B => AB Directa
A + B <= AB Inversa
TALLER
1. La energía de activación puede definirse como:
B. La diferencia entre el contendido energético del complejo activado y el de los reactivos.
2. Del complejo activado que aparece en el transcurso de una reacción química podemos decir que:
A. Su contenido energético es mayor que el de los productos y es también mayor que el de los reactivos
3. Indicar cual de los siguientes factores no influye sobre la velocidad de reacción:
B. Valor de la constante de equilibrio Kc.
4. Algunos de los factores que alteran o pueden alterar la velocidad de una reacción cualquiera son:
C. Las variaciones de la presión, de la temperatura, de la concentración y la presencia de catalizadores o inhibidores adecuados, pero solo en aquellas en las que intervengan gases, ya que de otra forma, la presión no podría actuar
5. Señale el enunciado que considere correcto:
D. En la mayoría de las reacciones químicas ordinarias al aumentar la temperatura aumenta la velocidad de todas las etapas de reacción
6. Escribe la expresión para la constante de equilibrio (Kc) para cada una de las siguientes reacciones:
Kc = [CS2]*[H2]4 ÷ [CH4]*[H2S]2
Kc = [O2]4*[CS2] ÷ [CH4]*[CO2]
Kc = [NO]4*[H2O]6 ÷ [NH3]4*[O2]5
7. Cual es el valor de la Kc para el siguiente equilibrio?
Kc = [0,20]*[0,30] ÷ [0,30]*[0,033] = 0,06 ÷ 0,0099 = 6,06
4. En la atmósfera baja, el oxígeno se convierte en ozono (O3) mediante la energía proporcionada por los relámpagos:
A. Agregar O2 ->
B. Agregar O3 <-
C. Disminuir la temperatura <-
D. Reducir el volumen de el contenedor ->
E. Agregar un catalizador - no pasa nada
5. De acuerdo con el principio de LeChatelier, ¿el equilibrio se desplaza a productos o reactivos cuando se agrega O2 a la mezcla en equilibrio de cada una de las siguientes reacciones:
A.
Taller conceptual
1. Que son soluciones acuosas ?
2. Que son electrolitos ?
3. Explique los tipos de electrolitos
4. Explica las teorías que explican el compartimiento de ácidos y bases:
A. Arrehenius
B. Bronsted-lowy
C. Lewis
5. Que es la potencia de hidrógeno o pH ?
6. Explique el proceso de disociación iónica del agua
DESARROLLO
1. Una solución acuosa es cualquier solucion que tiene agua.
Generalmente, las soluciones acuosas son de caráter ácido, debido a que el
agua, si se mezcla ocn algunos otros componenetes puede donar protones
hidrógeno al medio, ahciendo asi que sea acido.
2.Los electrolitos son unas substancias, que al disolverse
en el agua de las células del cuerpo se rompen en pequeñas partículas que
transportan cargas eléctricas. El papel que juegan es el de mantener el
equilibrio de los fluidos en las células para que éstas funcionen
correctamente. Los electrolitos principales son el sodio, el potasio y el
cloro, y en una medida menor el calcio, el magnesio y el bicarbonato.
3. *Electrolitos Fuertes : los que se ionizan totalmente en
solución acuosa al pasar corriente eléctrica como las ácidos, como H2SO4, HCl,
HNO3,
Algunas sales iónicas como el NaCl, LiCl, KCl,
*Electrolitos
débiles: Son los que se ionizan parcialmente en sol. acuosa y pueden ser los
acidos débiles como el CH3COOH acido acético, o vinagre, el CH3CH2CH2OH,el
alcohol, que son muy débiles y son orgánicos, y el H2O que presentan enlaces
covalentes
*No electrolitos:
De plano son las sustancias que no conducen la corriente eléctrica ni se
disocian en sol. acuosa como el azúcar, la madera, el vidrio etc.
4.A.La teoría de Arrhenius ha sido objeto de críticas. La
primera es que el concepto de ácidos se limita a especies químicas que
contienen hidrógeno y el de base a las especies que contienen iones hidroxilo.
La segunda crítica es que la teoría sólo se refiere a disoluciones acuosas,
cuando en realidad se conocen muchas reacciones ácido-base que tienen lugar en
ausencia de agua.

![K_c = \rm \frac{([H^+] \cdot [OH^-])}{[H_{2}O]}](http://upload.wikimedia.org/math/d/b/7/db7fa65812f0bfc92f753d6a515dc806.png)
![K_c \cdot \mathrm{[H_{2}O]} {= K_w =} \rm{[H^+] \cdot [OH^-]} = 1,0\cdot10^{-14}](http://upload.wikimedia.org/math/5/2/3/523de78fb2c74944d599ccbb85fd9687.png)
TEMA EQUILIBRIO EN SOLUCIONES SATURADAS
Calculo de constante del producto de salubridad
Los experimentos en el laboratorio pueden medir las concentraciónes de iones en una solución saturada. Por ejemplo, podemos hacer una solución saturada de CaCO3 al agregar solido al agua y agitar hasta tener el equilibrio. Luego mediríamos las concentraciones de Ca2 + CO32- en solución
GUIA para calcular ksp
1. Escribe la ecuación de equilibrio para la disociación del compuesto iónico
2. Escribe la expresión Ksp con la molaridad de cada ion elevada a una potencia igual a su coeficiente.
3. Sustituye la molaridad de cada ion en Ksp y se caliónico
SOLUBRIDAD MOLAR
Si conocemos la Ksp de un compuesto iónico podemos usarla para calcular la solubridad molar(s) del compuesto, es el numero de moles de soluto disuelto en 1 litro de solución.
PASOS
1. Escribe la ecuación de equilibrio para la disociación del compuesto iónico
2. Se escribe la expresión de la Ksp
3. Sustituye la S para la molaridad de cada ion en la Ksp
4. Calcula la solubridad molar(s)
FUERZA DE ACIDOS Y BASES
- Acidos fuertes y debiles
La fuerza de los acidos se determina mediante las moles de H3O+ que se forman por cada mol del acido que disuelve la fuerza de las bases. Se determina mediante las moles de OH-, este proceso se denomina disociacion.
Los acidos fuertes ceden protones tan facilmente que su disociacion en el agua es 100%.
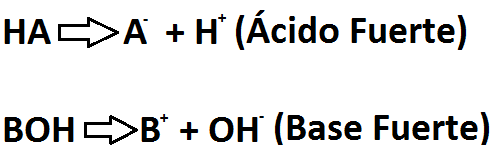
Los acidos debiles se disocian ligeramente en agua, lo que significa que solo un pequeño porcentaje se disuelve.
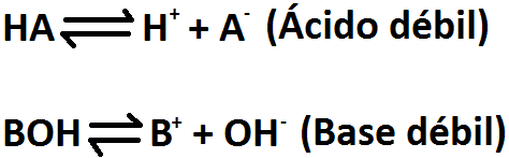


EQUILIBRIO IONICO DEL AGUA

B.Las definiciones
de Arrhenius de los ácidos y bases son muy útiles en el caso de las soluciones
acuosas, pero ya para la década de 1920 los químicos estaban trabajando con
disolventes distintos del agua. Se encontraron compuestos que actuaban como
bases pero no había OH en sus fórmulas. Se necesitaba una nueva teoría.
C.La historia del
desarrollo de la teoría de los ácidos y bases no estaría completa sin al menos
un breve vistazo al modelo de Lewis de los ácidos y bases. En el año de 1923
Lewis propuso el concepto más general de ácidos y bases y también introdujo el
uso de las fórmulas del electrón - punto. De hecho, el empleo de pares
electrónicos en la escritura de fórmulas químicas es también la base del modelo
ácido - base de Lewis.
5.El pH es una medida de acidez o alcalinidad de una
disolución. El pH indica la concentración de iones hidronio [H3O]+ presentes en
determinadas disoluciones.
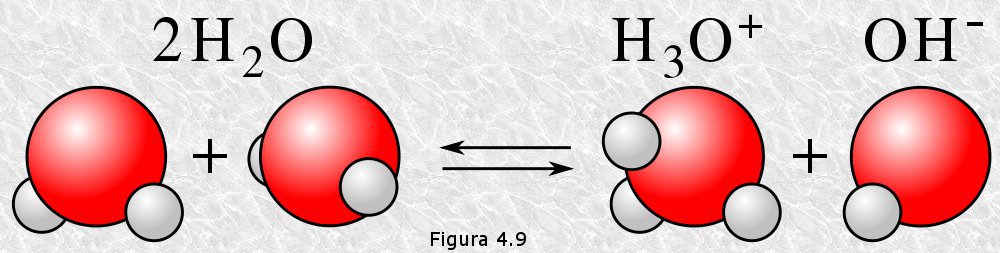
6. Las propiedades de las disoluciones dependen del
equilibrio del solvente, las disoluciones acuosas dependen del equilibrio de la
disociación del agua. El agua, el disolvente universal, tanto en fase líquida y
pura como actuando de disolvente subsiste en un estado de equilibrio dinámico transformándose
el agua en protones, protón: H+ e hidróxido: OH-

Donde aq significa acuoso. Esta disociación, en dirección a
la derecha ocurre únicamente hasta que el equilibrio se alcanza, después ocurre
en ambas direcciones a la misma velocidad. Aproximadamente una de cada 500
millones de moléculas de agua se disocia. La ecuación se puede escribir igual
que la de cualquier disociación:
![K_c = \rm \frac{([H^+] \cdot [OH^-])}{[H_{2}O]}](http://upload.wikimedia.org/math/d/b/7/db7fa65812f0bfc92f753d6a515dc806.png)
Siendo Kc la constante de disociación del agua, debido a que
la disociación es prácticamente siempre la misma, se puede combinar con una
nueva constante Kw:
![K_c \cdot \mathrm{[H_{2}O]} {= K_w =} \rm{[H^+] \cdot [OH^-]} = 1,0\cdot10^{-14}](http://upload.wikimedia.org/math/5/2/3/523de78fb2c74944d599ccbb85fd9687.png)
TEMA EQUILIBRIO EN SOLUCIONES SATURADAS
Calculo de constante del producto de salubridad
Los experimentos en el laboratorio pueden medir las concentraciónes de iones en una solución saturada. Por ejemplo, podemos hacer una solución saturada de CaCO3 al agregar solido al agua y agitar hasta tener el equilibrio. Luego mediríamos las concentraciones de Ca2 + CO32- en solución
GUIA para calcular ksp
1. Escribe la ecuación de equilibrio para la disociación del compuesto iónico
2. Escribe la expresión Ksp con la molaridad de cada ion elevada a una potencia igual a su coeficiente.
3. Sustituye la molaridad de cada ion en Ksp y se caliónico
SOLUBRIDAD MOLAR
Si conocemos la Ksp de un compuesto iónico podemos usarla para calcular la solubridad molar(s) del compuesto, es el numero de moles de soluto disuelto en 1 litro de solución.
PASOS
1. Escribe la ecuación de equilibrio para la disociación del compuesto iónico
2. Se escribe la expresión de la Ksp
3. Sustituye la S para la molaridad de cada ion en la Ksp
4. Calcula la solubridad molar(s)
FUERZA DE ACIDOS Y BASES
- Acidos fuertes y debiles
La fuerza de los acidos se determina mediante las moles de H3O+ que se forman por cada mol del acido que disuelve la fuerza de las bases. Se determina mediante las moles de OH-, este proceso se denomina disociacion.
Los acidos fuertes ceden protones tan facilmente que su disociacion en el agua es 100%.
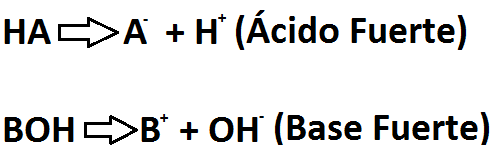
Los acidos debiles se disocian ligeramente en agua, lo que significa que solo un pequeño porcentaje se disuelve.
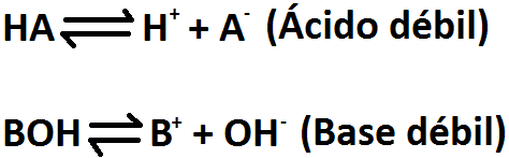


valores Ka y Kb para acidos y bases debiles
EQUILIBRIO IONICO DEL AGUA
-Kw: constante de ionizacion del agua
-PH: potencial de hidrogeno
-POH: potencial de basicidad (OH-)
-Calculos quimica PH, POH [H3O+] [OH-]
El agua por ser una sustancia amfotera se comporta como acido y base debil.

